Hukum Termodinamika, (Hukum Kekekalan Energi, Persamaan Gas Ideal, Termodinamika I, Termodinamika II)
Hukum Termodinamika
7.1 Hukum termodinamika I
Hukum pertama termodinamika adalah hukum konversi energi, hukum ini menyatakan bahwa ENERGI TIDAK DAPAT DICIPTAKAN ATAU DILENYAPKAN, energi hanya dapat diubah dari bentuk satu ke bentuk lainnya. |
| Dinamika perubahan energi pada suatu benda kerja |
Hukum pertama Termodinamika dapat ditulis sebagai berikut ;
EP1 + EK1 + ED1 + EA1 + = EP2 + EK2 + ED2 + EA2 +
Untuk sistem terbuka dimana ada pertukaran energi dan massa dari sitem ke lingkungan atau sebaliknya, maka persamaan energi di atas dapat dijabarkan sebagai berikut
Jadi Hukum termo pertama dapat diutuliskan secara sederhana dengan persamaan berikut (untuk sistem terbuka) masuk keluar E = E atau DEP + DEK + DH + DQ = DW
 |
| Proses perubahan energi pada sistem terbuka |
Jika Hukum termodinamika pertama dituliskan secara sederhana untuk sistem tertutup, dimana massa tidak dapat melintas batas sistem, maka suku EP, EK dan EA dapat dihilangkan dari persamaan. Persamaan dapat ditulis kembali menjadi:
DEP + DEK + DpV + DQ = DW + DU DQ = DW + DU
Jadi untuk sistem tertutup persamaannya menjadi DQ = DW + DU
 |
Proses perubahan energi pada sistem tertutup
|
Hukum-hukum termodinamika yang sudah diuraikan di atas adalah sangat berguna dalam menganalisis persoalan mesin-mesin konversi energi sederhana, sebagai contoh di bawah ini diuraikan pemodelan termodinamikanya.
7.1.1 Konversi energi pada turbin
Turbin adalah salah satu mesin konversi energi yang cukup penting.Turbin di industri biasanya turbin uap atau gas. Keduanya merupakan alat ekspansi yang menghasilkan kerja mekanik poros. Di bawah ini ditunjukkan perhitungan kerja turbin sederhana. |
Konversi energi pada turbin
|
7.1.2 Konversi pada pompa
Pompa juga merupakan alat mesin konversi energi, tetapi mesin ini banyak diaplikasikan sebagai alat bantu proses konversi. Sebagai contoh pompa banyak dipakai sebagai alat sirkulasi air pada instalasi pembangkit daya tenaga uap. Pompa bekerja dengan penggerak dari luar. Jadi mesin ini adalah pengguna energi. Di bawah ini diberikan persoalan tentang pompa sentrifugal sederhana.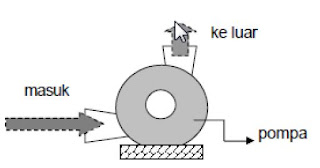 |
Konversi pada pompa
|
7.2 Hukum termodinamika II
Tidak mungkin membuat siklus mesin yang mengubah energi panas yang ditambahkan, semuanya menjadi kerja. Konsep efisiensi seperti yang telah disebutkan yaitu: |
| Skema sederhana dari hukum termodinamika II |
Aplikasi prinsip-prinsip dasar termodinamika pada mesin menggunakan fluida kerja yang dianggap ideal. Perumusannya adalah sebagai berikut:
pv = mRT
dengan
R = Ru/M ( Konstanta gas)
= 0,2870 kJ/Kg.K ( untuk udara)
Ru = 8,31447 kJ/kmol.K (konstanta gas ideal)
8. Persamaan keadaan gas ideal
Gas ideal adalah gas yang dalam setiap keadaan mematuhi persamaan keadaan gas ideal yaitu:pV =mRT
pv =RT
dengan R = adalah konstanta gas spesifik, untuk udara R = 286,8 J/KgK
Pada suatu siklus termodinamika persamaan keadaan prosesnya selalu berubah mengikuti beberapa proses yang saling terkait. Ada tiga besaran yang selalu terkait dan dapat diukur langsung yaitu tekanan (p), temperatur (T) dan volume (V). Adapun proses keadaan termodinamika adalah sebagai berikut.
8.1 Proses volume konstan
 |
| Diagram p-v proses tekanan konstan |
8.2 Proses temperatur konstan
Pada proses ini konstanta n pada politropik berharga n = 1 dan T= C |
| Diagram p-v proses temperatur konstan |
8.3 Proses Adiabatis (dq = 0)
Pada proses ini konstanta n pada politropik berharga n = 1 dan T= C |
| Diagram p-v proses adiabatik |
8.4 Proses politropik ;
secara umum pesamaan keadaan gas ideal dapat dirumuskan sebagai berikut |
| Diagram p-v proses politropik |
Bentuk energi yang ada di alam antara lain:
- Energi adalah suatu besaran turunan dengan satuan N.m atau Joule. Energi dan kerja mempunyai satuan yang sama
- Energi Kinetik ; energi suatu benda karena bergerak dengan kecepatan V
- Energi potensial adalah energi yang tersimpan pada benda karena kedudukannya.
- Energi potesial pegas adalah energi yang dimiliki oleh benda yang dihubungkan dengan pegas untuk berada pada kedudukan tertentu karena penarikan pegas.
- Energi mekanik pada benda-benda yang berputar misalnya poros mesin-mesin fluida (turbin, pompa, atau kompresor) dinamakan Torsi, yaitu energi yang dibutuhkan atau dihasilkan benda untuk berputar dengan gaya sentrifugal F dimana energi tersebut pada r tertentu dari pusat putaran.
- Energi Aliran atau kerja aliran adalah kerja yang dilakukan oleh fluida yang mengalir untuk mendorong sejumlah massa m ke dalam atau ke luar sistem.
- Energi Panas (Q) yaitu energi yang ditransfer ke atau dari subtansi tertentu karena perbedaan temperatur.
- Energi dalam (U); energi dari gas karena pergerakan pada tingkat molekul, pada gas ideal hanya dipengaruhi oleh temperatur saja.
- Entalpi (H); sejumlah panas yang ditambahkan pada 1 mol gas pada tekanan konstan, dengan cp panas jenis pada tekanan konstan
- Energi yang tersedia ; bagian dari panas yang ditambahkan ke sistem yang dapat diubah menjadi kerja.



Comments
Post a Comment